Узгодження постаналітичного етапу згідно зі стандартом ISO 15189:2023

Постаналітичний етап тестування визнано фундаментальним для підвищення якості та ефективності лабораторної інформації. Дані показують, що цей етап є вікном можливостей для ініціатив удосконалення та гармонізації, але йому приділяють недостатньо уваги. У статті буде розглянуто лабораторний звіт згідно зі стандартом ISO 15189:2023.
Стандарт ISO 15189:2023
Стандарт ISO 15189:2023 для акредитації медичних лабораторій визначає постаналітичну фазу як «процеси, що відбуваються після обстеження, включаючи перегляд результатів, форматування, оприлюднення, звітування та збереження результатів обстеження, утримання та зберігання клінічного матеріалу, зразка та утилізація відходів". Це визначення, однак, не враховує етапи, які виконуються після передачі лабораторних звітів і які є вирішальними для замикання циклу:
- підтвердження отримання даних;
- інтерпретація;
- використання;
- подальше спостереження;
- документування.
Ці кроки були згруповані в так звану «пост-пост-аналітичну фазу». Навіть якщо ці останні кроки циклу не знаходяться під прямим контролем лабораторних фахівців, вони є важливими змінними, які впливають як на цінність лабораторної інформації, так і на результат пацієнта.
Від даних до інформації
Дані – це числа, величини, сутності та факти, як, наприклад, результати лабораторних досліджень. Однак інформація генерується, коли цим даним надається значення, оскільки дані без інтерпретації є фактами без розуміння. У випадку лабораторних результатів, числові дані повинні супроводжуватися іншими параметрами, які зазвичай визначаються як «компаратори» (головним чином, але не тільки, термінологією, одиницями вимірювання, контрольними значеннями, межами прийняття рішення та інтерпретаційними коментарями), спрямованими на те, щоб зробити дані «придатними». З точки зору користувача, будь то лікар чи пацієнт, перетворення даних у корисну інформацію є єдиним, що має значення, оскільки саме ця інформація, а не необроблені аналітичні результати, впливає на клінічні міркування та прийняття рішень. У той час як фахівці лабораторії, перш за все, повинні забезпечувати точність і надійність лабораторних результатів, повідомлення про аналітичні результати має супроводжуватися іншими важливими інструментами, які дозволяють правильно інтерпретувати та використовувати лабораторну інформацію для процесу прийняття клінічних рішень і лікування пацієнтів. Необхідність удосконалення постаналітичної фази була синтезована як «хороша постаналітична якість робить хорошу лабораторну інформацію», визнаючи п’ять прав, які повинні бути досягнуті, щоб гарантувати, що аналітичні результати мають значення та цінність. Тільки таким чином лабораторна інформація може відповідати кінцевій меті лабораторної медицини, яка полягає в покращенні результатів здоров’я.
Гармонізація постаналітичної фази: звіт
Оскільки це в основному вимагає спілкування за участю сторін (тобто лаборантів, лікарів, спеціалістів з інформаційних технологій та пацієнтів), які розмовляють різними мовами, постаналітична фаза гармонізації є досить складною проблемою. Зокрема, лабораторний звіт є запорукою надання користувачам правильної інформації. У своїй основоположній статті 1976 року, опублікованій у Lancet під назвою «Звіти про клінічну хімію. Проблеми та пропозиції», Алан М. Болд наголосив на необхідності «стандартизації форматів звітів», запропонувавши звітувати про 13 пунктів, 7 з яких були визначені як «суттєві», а решта 6 як «додаткові функції», як зазначено в таблиці нижче "Лабораторний звіт: загальні вимоги".
Лабораторний звіт: загальні вимоги
| Суттєві | Додаткові функції |
|
|
Болд також підкреслив, що «всі звіти повинні включати вказівки щодо патологій, бути в кумулятивному форматі та містити реалістичне твердження про аналітичну надійність». На жаль, через кілька десятиліть наявні докази демонструють низьку відповідність описаним вимогам, що, крім того, мало приділялося уваги в літературі. Вимоги до постаналітичної фази, яка називається процесами після експертизи, описані в підпунктах 7.4.1 і 7.4.2 міжнародного стандарту ISO 15189 як «звіт про результати», «перегляд результатів і випуск», «критичні звіти про результати», «особлива увага щодо результатів», «додаткова інформація для звітів», «поправки до звітних результатів» і «обробка зразків після дослідження». У документі деяких робочих груп Європейської федерації лабораторної медицини (EFLM) підкреслюється необхідність використання ISO 15189 як «систематичної основи для вдосконалення практики оприлюднення результатів, щоб запропонувати критерії для процедур для отримання відповідного звіту про результати.
Управління оприлюдненням результатів має бути спрямоване на запобігання помилковим висновкам без затримки поширення даних, які є важливими та точними. Покращене представлення лабораторної інформації може сприяти швидкій інтерпретації та більш точному діагнозу та лікуванню. Однак представлений звіт показує, що більшість лабораторій не в змозі відобразити належні зусилля у наданні високоякісних аналітичних даних у найкоротший термін з мінімальним рівнем помилок протягом усього медичного обслуговування. Вони не використовують повноцінно сучасні рішення інформаційних технологій або автоматизовану обробку для агрегації даних.
Основні вимоги до лабораторного звіту
Лабораторний звіт повинен містити принаймні дані про:
- особу пацієнта;
- час отримання зразка;
- одиниці вимірювання;
- референтні інтервали та/або межі клінічного рішення, якщо вони доступні;
- терапевтичний діапазон для препаратів та пояснювальні коментарі, якщо це необхідно.
Вимоги до звітів, описані в ISO 15189, у пунктах 7.4 «Процеси після обстеження» та 7.2 «Процеси перед обстеженням», включають важливі вимоги щодо необхідності «однозначного відстеження пацієнта до запиту та зразка, ідентифікації та контактна інформація запитувача, ідентифікація запитуваної(их) експертизи». Важливо, що міжнародний стандарт рекомендує, щоб «результати обстеження повідомлялися точно, чітко, недвозначно та відповідно до будь-яких конкретних інструкцій у процедурі обстеження», таким чином підкреслюючи взаємозв’язки між різними етапами процесу тестування.
У стандарті підкреслюється важливість терміну «однозначна ідентифікація», оскільки в ньому зазначено, що «Ідентифікатори логічного спостереження імен та кодів (LOINC) і номенклатура властивостей і одиниць (NPU, NGC) і SNOMED CT є прикладами електронної ідентифікації. Термінологія у звіті повинна співпадати з узгодженими на міжнародному рівні системами (наприклад, системами ідентифікаторів логічних спостережень і кодів (LOINC) або системами номенклатури властивостей і одиниць (NPU)), а використання міжнародної системи одиниць (SI) має сприятися».
Обмін результатами лабораторних досліджень між різними постачальниками медичних послуг вимагає стандартизованої термінології, яка використовується для чіткого визначення:
- лабораторного тесту (наприклад, «культура бактерій»);
- досліджувані властивості (тип властивості, такий як «концентрація альбуміну в плазмі крові»);
- типи зразків (наприклад, артеріальна кров, 24-годинний збір сечі, спинномозкова рідина);
- анатомічне розташування зразка (наприклад, зразок зі шкіри лівого коліна);
- аналіти (компоненти або елементи, такі як натрій, аланінтрансаміназа, антитіла до бруцели);
- тип вимірюваної властивості (наприклад, концентрація маси, об’єм, кількість фракцій);
- результати для номінальних або порядкових значень результату (швидкість, частота, маса тощо);
- одиниці, в яких представлено значення (для кількісних значень результату).
Документ також рекомендує, щоб «оскільки країни-члени використовують різні лабораторні системи кодування, слід враховувати не лише код і назву тесту, але й додаткові складові специфікації тесту та результату».
Таким чином, чітко необхідна гармонізація на постаналітичній фазі для транскордонної допомоги, що має вирішальне значення для забезпечення узгодженості та уникнення фрагментації та дублювання запитів на тестування, але така ж узгодженість має бути гарантована на місцевому, регіональному, національному та міжнародному рівнях. Проте, за словами Роберта Флетмана, «поточні варіації на практиці щодо номенклатури, референтних інтервалів, маркування, одиниць, стандартизації та простежуваності між аналітичними методами, а також представлення кумулятивних даних результатів є неефективними та незручними, або, що ще гірше, загрожують безпеці пацієнтів. Усі аспекти лабораторних послуг у всьому процесі тестування в кінцевому підсумку залежать від стислого, надійного спілкування». Існує високий ризик помилок у поточних форматах звітів, включаючи «неправильне тлумачення з різними одиницями, порівняно з референтними інтервалами та хронобіологією, нерозуміння відмінностей методів у результатах та варіації у позначенні неправельних результатів». Хоча зрозуміло, що аналітичний результат завжди повинен надаватися з одиницею, передача результату без одиниці ґрунтується на припущенні, що одержувач знає правильну одиницю. Хоча це рідко може бути проблемою на місцевому рівні для звичайних аналітів, багато аналізів на ліки та гормони часто оцінюються в різних підрозділах між лабораторіями, штатами та країнами. Якщо надається одиниця, клініцист все одно може ненавмисно припустити використання одиниці від іншого постачальника тестів, з яким він знайомий.
Величина результату часто сильно відрізняється для одного і того ж аналіту, наведеного в різних одиницях, і ці відмінності іноді можуть бути небезпечно незначними або становити ризик для безпеки пацієнта. Це було описано, наприклад, для результатів гемоглобіну, які іноді виражаються не в г/л (правильні одиниці), а в г/дл (10- кратна різниця).
Навіть якщо під час «паперової ери» з’явилися варіації в лабораторних звітах, деякі фактори зараз ставлять під загрозу надійність нових електронних систем, які повинні забезпечувати функціональну сумісність (зв’язок і отримання фактичного повідомлення між апаратним забезпеченням, програмним забезпеченням і людьми) і семантичну сумісність (успішне кодування та декодування переданої інформації).
Крім того, електронні звіти повинні забезпечувати:
- гнучкість для відображення результатів, доступних і зрозумілих для медичного персоналу та пацієнтів;
- функціональність для відображення додаткової інформації;
- параметри фільтрації складності;
- доступ до лабораторних даних про продуктивність;
- функціональність для уточнення місця групування або розділення результатів є доречним;
- графічне представлення сукупних результатів.
Невизначеність вимірювання
Похибка вимірювання (Measurement uncertainty — MU) є невід'ємною властивістю будь-якого кількісного результату вимірювання, яка виражає відсутність знання справжнього значення результату та включає фактори, які, як відомо, впливають на нього. Результат вимірювання є лише наближенням або оцінкою значення вимірюваної величини і, таким чином, завершується лише тоді, коли супроводжується твердженням про невизначеність цієї оцінки. Оскільки мінливості лабораторних результатів не уникнути, результат будь-якого вимірювання являє собою наближення або оцінку значення вимірюваної величини і, таким чином, є повним лише тоді, коли супроводжується твердженням про невизначеність цієї оцінки. Похибка вимірювання — це не тільки кількісна оцінка сумнівів щодо результату вимірювання та цінний показник якості результату, але й суттєва інформація, без якої результати вимірювань не можна осмислено інтерпретувати.
Обґрунтуванням для включення MU в лабораторні звіти є те, що діагностична невизначеність може випливати з неповної інформації в лабораторних звітах, що призводить до підвищеного ризику невідповідної інтерпретації лабораторних даних. Відповідно до ISO 15189 (підпункт 7.3.4) «Інформація MU повинна бути доступна користувачам лабораторії за запитом» і, отже, навіть якщо MU не включено до атрибутів звіту та не може вважатися певною постаналітичною вимогою, рекомендовано як інформація, яка має сприяти належній інтерпретації кількісних результатів (кількісних значень). Фактично, для багатьох лабораторних тестів аналітична якість (на основі встановлених специфікацій продуктивності) може змінюватися з часом і повинна бути покращена завдяки кращим діагностичним системам та/або вищій відповідності специфікаціям аналітичних характеристик (APS). Таким чином, правильна інтерпретація можлива лише на основі знання невизначеності лабораторних результатів, яка є результатом як аналітичних (наприклад, упередження та неточність), так і інших можливих джерел невизначеності (наприклад, переданалітичні проблеми).
Наведений підпункт ISO 15189 виглядає неоднозначним, оскільки включення MU «за запитом» є, перш за все, дуже складним з практичної точки зору, і, по-друге, це не дозволяє багатьом користувачам отримувати інформацію, яка може покращити інтерпретацію даних лабораторних досліджень. За останнє десятиліття, співробітники відділу лабораторної медицини лікарні університету Падуї, включили до лабораторних звітів інформацію про помилку загальної аналітичної помилки (TAE) і RCV (стандартне значення зміни) для вимірюваних величин, які частіше використовуються для моніторингу пацієнтів, після залучення клініцистів в обговоренні корисності цієї інформації. Нещодавно в документі, присвяченому звіту про MU у звіті лабораторії, ми запропонували замінити TAE на MU, щоб відповідати поточному найсучаснішому рівню, як показано на рисунку.
Повідомлення про MU у звітах лабораторії
Референтні інтервали (RI) і межі прийняття рішень
Референтні інтервали (RI) і межі рішення (DL) є цінним інструментом для інтерпретації результатів та є важливою частиною лабораторного звіту та найбільш часто використовуваним інструментом порівняння в лабораторній медицині. RI, статистичні довірчі межі для типового розповсюдження результатів, які можна знайти у здоровій референтній популяції, призначені для підтвердження здоров’я (відсутності будь-яких захворювань) з високою специфічністю (зазвичай 95 %). Існують деякі спеціальні форми референтних лімітів для речовин, які зазвичай не зустрічаються у здорових людей, наприклад, терапевтичні діапазони рівнів ліків, ліміти виявлення токсинів (або наркотичних речовин), дозволені ліміти, наприклад, для алкоголю.
Встановлення RI з використанням «прямих методів» передбачає визначення та відбір референтної популяції, збір зразків, аналітичні вимірювання та статистичний аналіз. Було описано статистичні методи для кількох аспектів встановлення RI, включаючи відповідне виявлення та видалення викидів, розподіл RI за змінних (наприклад, віком і статтю) та обчислення довірчих інтервалів (CI) навколо контрольних меж. В ідеалі на RI має впливати лише населення, яке обслуговується, а не використовувані аналітичні системи, за умови, що вони достатньо гармонізовані або стандартизовані. В епоху великих даних так званий «непрямий підхід», який базується на використанні великих обсягів даних, які вже зберігаються в лабораторних базах, для визначення та/або верифікації RI, пропагував замінити прямий підхід. Непрямий підхід пропонує кілька переваг перед звичайним прямим підходом, включаючи зниження витрат і простіше застосування в конкретних вікових групах, і багато непрямих алгоритмів було розроблено для визначення RI.
Для багатьох вимірюваних величин використання великих даних може забезпечити додатковий підхід до традиційного методу визначення загального RI, якому часто заважають теоретичні та практичні проблеми. Однак справжнє питання полягає у виборі між RI та DL. Межі прийняття рішень є більш клінічно орієнтованими, оскільки вони пов’язані з конкретним клінічним станом і, як правило, мають на меті підтвердити наявність конкретного захворювання або клінічного ризику з відповідно високою чутливістю.
Було визначено деякі показники для екстрааналітичного етапу лабораторних досліджень і, зокрема, щодо корисності звітування про RI та DL, а саме:
- правильне використання RI в порівнянні з DL;
- звичайний в порівнянні з специфічним для лабораторії RI;
- правильне використання референтного інтервалу, пов’язаного зі статтю;
- правильне використання референтного інтервалу, пов’язаного з віком.
Переваги DL, зокрема у дотриманні рекомендацій з клінічної практики та визначенні аналітичних цілей, були доведені у випадку, загального холестерину та холестерину ЛПНЩ при дисліпідемії, глюкози та HbA1C при діабеті та серцевого тропоніну при гострій коронарній хворобі.
Зміна референтного значення
Для моніторингу серійних результатів сукупність доказів вказує на те, що так звану зміну референтного значення (RCV) слід рекомендувати як більш ефективний компаратор, ніж RI та DL. Цей простий інструмент для моніторингу серійних результатів від окремої людини, базується на припущенні, що для того, щоб зміна була суттєвою, різниця в серійних результатах має бути більшою, ніж властива варіація як з точки зору біологічної, так і аналітичної мінливості. Наявність надійних даних біологічної варіації (BV) є важливою для визначення специфікацій аналітичної ефективності (APS) і необхідною для встановлення зміни референтного значення (RCV). Європейське дослідження біологічної варіації (EuBIVAS), яке було розроблено протягом останніх кількох років і все ще триває завдяки зусиллям Робочої групи EFLM з BV (WG-BV), надало доказові дані щодо BV, таким чином дозволяючи клінічним лабораторіям безпечно включати RCV у свої звіти. Переваги звітності про RCV у моніторингу пацієнтів були продемонстровані при багатьох захворюваннях і для багатьох вимірюваних величин, включаючи пухлинні та кісткові маркери, а також в оцінці успішності та відповідності терапевтичних заходів.
Звіт про критичні результати
Однією з головних проблем, пов’язаних з постаналітичною діяльністю, є повідомлення про критичні результати (CR), які, за визначенням, вказують на небезпечний для життя стан із значним несприятливим результатом для пацієнта, якщо не вжити негайних рятувальних дій. Розробка політики щодо CRs, яка все ще використовується сьогодні, стала якісною практикою в процедурах медичних лабораторій, багато з яких запровадили системи для повідомлення про CRs.
ІSO 15189 визначає три вимоги до звітування про критичні результати:
- користувачу або іншій уповноваженій особі повідомляється якомога швидше на основі наявної клінічної інформації;
- вжиті дії задокументовані, включаючи дані (отримані), час, відповідальну особу, особу, яку було повідомлено, передані результати, перевірку точності повідомлення та будь-які труднощі, що виникли під час повідомлення;
- лабораторія повинна мати процедуру ескалації для персоналу лабораторії, коли неможливо зв’язатися з відповідальною особою.
Перша вимога ґрунтується на доказах того, що результат, який демонструє ризик виникнення небезпечного для життя стану, вважається результатом критичного ризику та має бути повідомлено уповноваженому персоналу якнайшвидше (не більше ніж через 1 годину), тоді як результат вказівка на потенційний несприятливий результат, який вважається результатом значного ризику, може мати більший час звітування. У будь-якому випадку лабораторія повинна мати процес звітування про критичні результати в найкоротші терміни за допомогою надійних і своєчасних систем сповіщення, щоб забезпечити своєчасне повідомлення.
Однак різні термінології, що використовуються, а також відмінності в практиках і політиках, описаних у літературі, вказують на необхідність більш узгодженого та систематичного підходу до повідомлення про критичні результати. Ініціативи з гармонізації повинні враховувати наступне:
- надійні межі значень повинні бути обрані для справжніх «небезпечних для життя» аналітів, відповідно до визначення;
- критичні значення повинні бути сформульовані з урахуванням характеристик пацієнтів (тобто віку, статі та етнічного походження);
- сповіщення повинно здійснюватися за допомогою найбільш ефективних інструментів звітності та комунікації;
- повинна бути встановлена політика, щоб визначити особу, відповідальну за повідомлення критичних значень, і відповідального за отримання цих значень;
- технологічні інструменти повинні дозволяти підтвердження критичних значень, сприяти зворотному зв’язку та запису даних, а також гарантувати, що індикатори контролюють і контролюють процес критичних значень.
Було чітко продемонстровано цінність повідомлення про критичні результати, яке призвело до зміни лікування у 98 % пацієнтів, які потрапили до хірургічних відділень, і у 90,6 % пацієнтів, які потрапили до медичних палат. Клініцисти провели додаткову оцінку нових ускладнень і станів у 70 і 60,4 % пацієнтів відповідно в хірургічних і медичних відділеннях і вжили подальших заходів у стаціонарному лікуванні після повідомлення про критичне значення. Більш ретельний моніторинг клінічного стану хворих проводився в 26 % і в 25,5 % випадків у хірургічному та медичному відділеннях відповідно. Клініцисти повідомили, що критичні значення були неочікуваними знахідками у 42,3 % пацієнтів, які були госпіталізовані до хірургічних відділень, і 43,0 % пацієнтів, які були госпіталізовані до медичних палат, таким чином підкреслюючи ключову роль, яку відіграє повідомлення про критичні результати в покращенні якості медичної допомоги та безпеки пацієнтів.
Інтерпретаційні коментарі
Надання порад щодо інтерпретації лабораторних результатів, постаналітична діяльність, є невід’ємною частиною клінічних лабораторних послуг, оскільки правильна клінічна інтерпретація лабораторних результатів є бажаним результатом лабораторних послуг.
Клінічні, технічні та фінансові каталізатори спричинили нинішній попит на пояснювальні коментарі та їхню бажаність. Клінічні драйвери включають безпеку пацієнтів, цінність інтерпретаційних коментарів, вимоги до якості в міжнародних стандартах для акредитації лабораторій, задоволеність лікаря, нові та складні лабораторні тести та освіту лікаря; технічні чинники включають відсутність узгодженості лабораторної інформації та розширення електронного обміну даними; фінансовими чинниками є конкуренція між клінічними лабораторіями та ініціативи щодо скорочення витрат.
У багатьох випадках цінність лабораторного результату може бути значно збільшена за допомогою супровідного пояснювального коментаря:
- несподівані результати через втручання (наприклад, від гетерофільних антитіл в імуноаналізі);
- певні знахідки, виявлені в лабораторії (наприклад, макропролактин або макроамілаза);
- розширення початкового запиту клініциста рефлексивним або рефлективним тестуванням (наприклад, ідентифікація моноклонального піку в електрофорезі сироватки).
Впровадження нових і складних тестів у повсякденну практику є ще одним головним стимулом для включення пояснювальних коментарів у звіт лабораторії. Це особливо вірно в деяких діагностичних областях, таких як коагуляція, аутоімунітет, тестування на алергію та молекулярна діагностика, які є серйозними проблемами, оскільки вимагають передового досвіду для правильного тлумачення лабораторних даних. Крім того, лікарі, які звертаються з проханням, все частіше сприймають пояснювальні коментарі, особливо коли вони надають клінічні поради щодо того, «що робити далі». Робоча група IFCC «Гармонізація оцінки якості пояснювальних коментарів» опублікувала основоположний документ, присвячений основним вимогам пояснювальних коментарів, включаючи потребу в освіті, підготовці, відповідній професійній кваліфікації та досвіді для надання пояснювальних коментарів. Крім того, було підкреслено важливість спеціальних схем зовнішньої оцінки якості (EQA) для сприяння покращенню якості коментарів і, зрештою, результатів для пацієнтів. Інтерпретаційні коментарі слід розглядати як фундаментальну частину стратегії, спрямованої на вдосконалення постаналітичного етапу лабораторних досліджень, але нещодавно надані дані також підкреслюють необхідність подальших ініціатив, спрямованих на забезпечення якості, гармонізацію та моніторинг інтерпретаційних коментарів.
Передбачувані одержувачі лабораторного звіту
Лабораторні тести зазвичай призначаються постачальником медичних послуг, звіти переглядаються лікарями, щоб діагностувати та/або лікувати своїх пацієнтів. Оптимальне представлення результатів лабораторних досліджень у цих випадках значною мірою залежить від конкретної медичної ситуації, і більшість рекомендацій, вимог та інформації, які повинні бути включені в лабораторний звіт, були розроблені з урахуванням цього типу реципієнта. Проте, окрім лікарів, результати лабораторних досліджень можуть бути представлені і пацієнтам. Кілька доступних досліджень, спрямованих на визначення форматів, які відповідають потребам і можливостям пацієнтів, показують, що результати в таких звітах повинні бути узагальнені, а їхнє значення повинно бути надане чіткою, зрозумілою та доступною, «немедичною» мовою. У міру того як системи охорони здоров’я рухаються до надання кожній людині повного доступу до власних даних, пов’язаних зі здоров’ям, люди все більше можуть отримати доступ до результатів своїх лабораторних досліджень через портали для пацієнтів. Потенційні переваги цього доступу включають зменшення навантаження на пацієнтів і підвищення задоволеності пацієнтів, лікування захворювань і прийняття медичних рішень, але також йдуть рука об руку із занепокоєнням щодо таких питань, як результати, які викликають плутанину або занепокоєння у пацієнтів. Насправді лише доступ не може надати повної користі від таких даних та інформації, а помилкова інтерпретація лабораторних результатів може спричинити занепокоєння пацієнта, потенційно завдаючи шкоди пацієнту.
Віттеман і Зікмунд-Фішер визначили 10 рекомендацій, щоб допомогти людям перетворити дані результатів у значущу інформацію та практичні знання:
- якщо це можливо, надайте чітке повідомлення для кожного результату (сигналізувати, чи є відмінності значущими чи ні);
- якщо це можливо, встановіть порогові значення для занепокоєння та дії;
- індивідуалізуйте систему відліку, дозволяючи спеціальні діапазони відліку;
- забезпечте доступність системи;
- надайте інструменти перетворення разом із результатами;
- проектування спільно з користувачами;
- дизайн для нових і досвідчених користувачів;
- зробіть так, щоб люди могли легко використовувати дані за своїм бажанням;
- співпрацюйте з експертами з відповідних галузей.
Використовуючи найкращі практики для представлення лабораторних результатів у спосіб, який допомагає людям зрозуміти та використовувати їх, ми можемо допомогти людям приймати обґрунтовані рішення щодо здоров’я та керувати своїм здоров’ям.
Використання навіть найпростіших графічних ліній із числами замість таблиць для представлення результатів тесту може зменшити сприйняття пацієнтом терміновості щодо значень, близьких до стандартного діапазону, і, отже, збільшити чутливість до варіацій значень тесту. Графічні візуальні дисплеї можуть підвищити значущість результатів тесту шляхом чіткого визначення можливих значень і використання кольорових підказок і оціночних міток: цей тип звітування даних, який збільшує можливість пацієнтів безпосередньо отримувати доступ і переглядати результати лабораторних тестів, виправдовується концепцією, що завдяки «розширенню можливостей пацієнта» пацієнти зможуть перевести доступ до тесту, що призводить до кращої підготовки до клінічних візитів і кращого самоконтролю хвороби, як показано на рисунка нижче.
Графічне представлення результатів лабораторних досліджень
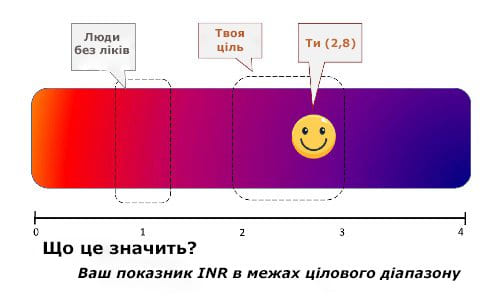
Підсумовуючи, проблема різних одержувачів лабораторних звітів, додаткова змінна, впливає на складність узгодження постаналітичної фази і, зокрема, лабораторного звіту.
Інтегративна діагностика та інтегрований звіт
Відповідно до Всесвітньої організації охорони здоров’я (ВООЗ), послуги охорони здоров’я повинні «керуватися та надаватися таким чином, щоб люди отримували безперервний комплекс послуг зміцнення здоров’я, профілактики захворювань, діагностики, лікування, ведення хвороб, реабілітації та паліативної допомоги, скоординовані на різних рівнях і місцях надання медичної допомоги в рамках і поза сектором охорони здоров’я, а також відповідно до їхніх потреб протягом усього життя».
«Інтегрована діагностика» (ID) була визначена як «конвергенція візуалізації, патології та лабораторних тестів із передовою інформаційною технологією (IT)». Діагнози залежать від багатьох компонентів, які включають не лише візуалізацію, але й клінічне спостереження, патологію, лабораторні та геномні тести. Центральну роль у медичній діагностиці в даний час відіграють рентгенологічні, клінічні лабораторії та патологоанатомічні відділення, які виконують переважно діагностичні дослідження. Однак ці дисципліни не працюють як єдине ціле. Швидше, вони є «острівцями великої кількості даних і надзвичайного внутрішньодисциплінарного досвіду, відокремленими один від одного та від наших клінічних колег інформаційними, фізичними та спеціальними бар’єрами». На сьогоднішній день існує надто низька координація між медичними спеціальностями, відповідальними за замовлення та проведення цих тестів, а також не приділяється достатньої уваги оптимальному замовленню та звіту про тести. Це зміниться у світі інтегрованої діагностики, де замість того, щоб покладатися на упередженість окремих постачальників у виборі тестів, для визначення найефективніших діагностичних алгоритмів використовуватимуться дані з різних джерел. Візуалізація буде розумно включена в ці інтегровані діагностичні алгоритми, доповнюючи інші методи діагностики, щоб максимізувати ефективність і мінімізувати відходи. Це, у свою чергу, може забезпечити більш швидкий, ефективний і точний процес прийняття клінічних рішень, що в кінцевому підсумку має забезпечити кращі клінічні та економічно ефективні результати. Незалежно від клінічних і екологічних сценаріїв, кілька ліній доказів зараз підтверджують роль, яку так звана «інтегрована діагностика» відіграватиме в осяжному майбутньому, дозволяючи не тільки раніші та точніші діагнози, але й заощаджуючи значні людські та економічні ресурси. У своїй основоположній статті з інтегративної діагностики Beauchamp та ін. наголошують на тому, що «клінічні питання можуть бути вирішені за допомогою діагностичної медицини «in vivo» та «in vitro», при цьому різні дисципліни об’єднують свої відповідні дані та повідомляють про інтерпретовані результати іншим постачальникам послуг і пацієнтам у комбінованому звіті». Інтегровані звіти, що об’єднують числові дані клінічних лабораторій із даними патології та зображень, можуть сприяти правильному тлумаченню та використанню діагностичної інформації.
Спільна система звітності про діагностику лабораторії, радіології та патології, яка об’єднує текст, дозорні зображення та молекулярні діагностичні дані в узгодженій інтерпретації, допоможе краще інформувати управлінські рішення. Хоча кілька вузьких місць все ще існують, інтегрований звіт повинен базуватися на стандартизації та, у свою чергу, заохочувати її: міждисциплінарна співпраця сприяє використанню контрольованої термінології та стандартизованих структур звітності, що робить можливим оцінювання в багатьох когортах пацієнтів. Робочі процеси інтеграції клінічної лабораторії, патології та радіології повинні забезпечувати ефективну комунікацію, потік комунікацій і зв’язувати структуровані результати діагностики від лабораторів і патологів з результатами радіологів. ID також може залучити додаткові людські та обчислювальні ресурси для роботи з цими, по суті, необробленими даними, таким чином надаючи інформацію, корисну для діагностики та лікування окремих пацієнтів, для лікування захворювань у певній популяції та для покращення управління здоров’ям.
Штучний інтелект у постаналітичній фазі
Досягнення в розумінні біології, патофізіології хвороб і молекулярної медицини в поєднанні з технологічним розвитком надали лабораторній медицині центральну роль, починаючи від підтримки благополуччя і закінчуючи профілактикою захворювань, раннім виявленням, прогнозом, моніторингом і керівництвом персоналізованої терапії. Настав час належним чином керувати інтерпретацією та використанням величезної кількості даних, які щодня генерують клінічні лабораторії, для покращення догляду за пацієнтами. Моделі алгоритмів прийняття рішень для звітування про результати, системи підтримки клінічних рішень і штучний інтелект (ШІ) все більше визнаються основними інструментами для досягнення цієї мети. Комп’ютеризовані системи підтримки прийняття клінічних рішень (CDSS), які представляють зміну парадигми в сучасній охороні здоров’я, використовуються для допомоги клініцистам у складних процесах прийняття рішень і можуть бути корисними в лабораторному тестуванні та інтерпретації. Забезпечення підтримки клінічних рішень для клініцистів та лікарів загальної практики призведе до всебічної інтерпретації всіх, навіть складних, діагностичних процедур у контексті окремого пацієнта, таким чином дозволяючи прийняти стратифіковане терапевтичне рішення.
Інтерактивні інструменти машинного навчання були розроблені для покращення агрегації даних, інтерпретації та звітності про результати. Ця галузь, яку загалом називають штучним інтелектом, але включає в себе різні системи, такі як машинне навчання та штучні нейронні мережі, наразі привертає все більшу увагу та, безсумнівно, дасть нові ідеї та та покращить цінність лабораторної інформації.
Однак, якщо лабораторні результати та інформація не стандартизовані та гармонізовані, використання машинного навчання, великих даних і, загалом, штучного інтелекту може бути не тільки токсичним для багатьох дослідників у медицині, але також може поставити під загрозу надійність діагнозів та ефективність лікування хворого.
Висновки
За останні кілька десятиліть зосередження уваги на аналітичній фазі дозволило лабораторній медицині покращити якість та гарантію якості. Проте сукупність зібраних доказів демонструє, що екстра аналітичні фази вразливі до помилок, у тому числі ті, що мають ризик перетворення в діагностичні помилки та шкоди пацієнту. Було докладено чимало зусиль, щоб покращити доаналітичну фазу, тоді як постаналітична фаза, як видається, є проблемою, залишеною без уваги. Однак цей останній етап лабораторного тестування все більше визнається фундаментальним кроком у підвищенні якості та ефективності лабораторної інформації: все ще існує потреба замкнути цикл повного циклу тестування шляхом вдосконалення як лабораторного звіту, так і його передачі до користувачів.
Варто наголосити на важливості вдосконалення постаналітичної фази, щоб уникнути ризику неправильної інтерпретації тестів гемостазу, пов’язаних діагностичних помилок і несприятливих клінічних подій, пропонуючи стандартизацію/гармонізацію зареєстрованих одиниць вимірювання та референтних діапазонів, а також включення до лабораторних звітів пояснювальних коментарів і своєчасного звітування про критичні результати. Оскільки гармонізація відіграє фундаментальну роль у покращенні постаналітичного етапу, спеціалісти лабораторії, національні та міжнародні наукові товариства та федерації повинні посилити свої зусилля, щоб надати цінні вказівки та рекомендації, спрямовані на покращення як лабораторного звіту, так і його повідомлення користувачеві.
Дана інформація перекладена зі статті Маріо Плебані — почесний професор клінічної біохімії та клінічної молекулярної біології Університету Падуї в Італії та професор кафедри патології Медичного відділення Університету Техасу, Галвестон, США.
Plebani M. Harmonizing the post-analytical phase: focus on the laboratory report. Clin Chem Lab Med. 2024 Jan 8. doi: 10.1515/cclm-2023-1402. Epub ahead of print. PMID: 38176022.
Оригінал статті за посиланням.

Будьте першим, хто залишив відгук на “Узгодження постаналітичного етапу згідно зі стандартом ISO 15189:2023”